Selectividad de la membrana
Introducción
La bicapa lipídica de las membranas biológicas es impermeable a los iones y a las moléculas polares aunque dichas especies deban cruzar la las membranas para asegurar una función celular normal. La permeabilidad se la confieren dos clases de proteínas de membrana, las bombas y los conductos. Las bombas utilizan como fuente de energía el ATP o la luz para impulsar el transporte de iones o moléculas en condiciones termodinámicamente desfavorables (transporte activo). Los conductos, por el contrario, facilitan el flujo rápido de iones a través de la membrana a favor de gradiente (difusión facilitada).
Existen 2 tipos de bombas dirigidas por ATP, las ATPasas de tipo P y las bombas con dominio de unión a ATP de tipo casette (transportadores ABC o ATPasas de tipo A), ambos tipos sufren un cambio conformacional al unirse e hidrolizar al ATP lo que permite al ion poder cruzar la membrana. Otro mecanismo de transporte son los transportadores secundarios que utilizan el gradiente de ion para promover el transporte activo de otro.
Las bombas pueden establecer gradientes persistentes de iones concretos a través de las membranas. Los conductos iónicos específicos pueden permitir fluir a algunos iones rápidamente a través de las membranas a favor de su gradiente mientras que se bloquean para otros iones incluso estrechamente relacionados. Los conductos iónicos de apertura controlada desempeñan un papel crucial en el funcionamiento de nuestro sistema nervioso, actuando como interruptor que permite un flujo rápido de corriente.
Existen otros conductos llamado acuaporina que permiten un mayor flujo de agua en algunas células como las del riñón, ojo, glóbulos rojos.
También existen conductos intercelulares o nexus (“gap junction”) que permite el flujo de metabolitos o iones entre células. Por ejemplo, los nexus son responsables de la sincronización en la contracción de las células del musculo cardíaco asociados al latido.
Bombas dirigidas por ATP
►ATPasas de tipo P
El fluido extracelular de las células animales tiene una concentración salina similar a la del agua del mar. Sin embargo, las células deben controlar sus concentraciones intracelulares de sal para prevenir interacciones desfavorables con altas concentraciones de iones como el Ca2+ y para facilitar procesos específicos. Por ejemplo la mayoría de las células animales contienen una alta concentración de K+ y una baja concentración de Na+ en relación a la del medio externo. Estos gradientes iónicos se generan por un sistema de transporte específicos. Estas bombas están relacionadas desde el punto de vista evolutivo, que incluyen a las proteínas de bacterias, arqueas y todos los eucariotas. De particular interés son la ATPasa de Na+ - K+, la ATPasa de Ca2+, enzima que transporta el Ca2+ fuera del citoplasma y al retículo sarcoplásmico de las celular musculares y la ATPasa gástrica de H+ y K+, el enzima responsable de bombear suficientes protones al estómago para bajar el PH por debajo de 1.0. Estos enzimas y los cientos de homólogos conocidos se clasifican como ATPasas tipo P porque forman un intermediario fosforilado clave. En la formación de este intermediario, un grupo fosforilo que se obtiene de la hidrólisis del ATP, se une a la cadena lateral de un residuo de aspartato especifico conservado en la ATPasa para formar fosfoaspartato.
ATPasas de Na+ y K+
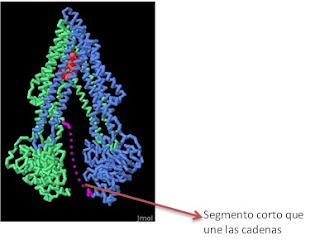
El ejemplo fisiológico mejor conocido es el mantenimiento de los gradientes de sodio y potasio a través de las membranas plasmáticas de las células. El líquido que rodea a las células de la mayoría de los animales es aproximadamente 140 mM en Na+ y 5 mM en K+. Sin embargo, las células animales mantienen en su citosol una concentración de Na+ de aproximadamente 10 mM y una concentración de K+ de alrededor de 100 mM. A pesar de que el Na+ y el K+ pasan muy lentamente a través de las membranas mediante difusión pasiva, estas desigualdades acabarían por desvanecerse sin un mecanismo que mantuviera la entrada de K+ y la salida de Na+. Este movimiento se realiza mediante la acción de la bomba de sodio-potasio Esta máquina molecular está formada por dos cadenas grandes (α) de 113 kilo Dalton cada una, y dos subunidades más pequeñas (β) de 55 kilodalton cada una. La subunidad α interviene directamente en el proceso de transporte y es una enzima que hidroliza ATP. El cambio de energía libre que se produce en esa reacción se emplea para impulsar el transporte. La subunidad α atraviesa la membrana 10 veces, formando un canal de múltiples hélices. El lugar de unión y fosforilación del ATP se encuentra en el lado citoplásmico. Mirando al exterior hay múltiples lugares de unión de esteroides cardiotónicos, entre ellos la ouabaina y la digitoxogeniina (digital), La subunidad β tiene una única hélice que atraviesa la membrana y transporta un gran polisacárido (20 kDa) en la superficie exterior y cuya función parece ser mantener en contacto a las 2 subunidades α en contacto y dentro de la membrana. También se conoce una subunidad extra llamada subunidad γ que a veces se asocia con función reguladora específica del tejido.
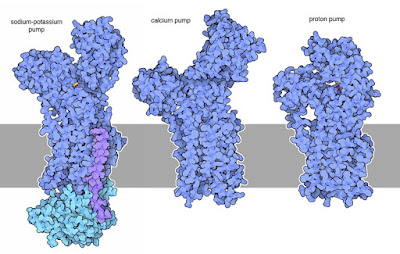 |
| Bombas más importantes - Sodio potasio, calcio y protónica. |
La bomba de sodio-potasio crea un gradiente electroquímico a través de las membranas celulares. El gradiente eléctrico, creado por el flujo de salida de iones de sodio más positivas que el flujo de entrada de iones de potasio positivos, resultando en un citoplasma relativamente cargado negativamente, se utiliza en las neuronas y los músculos para crear los potenciales de acción responsables de la función del sistema nervioso y la contracción muscular. También la exportación de sodio a partir de la célula proporciona la fuerza motriz para varios transportadores facilitados, que importan, aminoácidos y otros nutrientes a la célula. Además la translocación de sodio de un lado de un epitelio hacia el otro lado crea un gradiente osmótico que impulsa la absorción de agua. Casos importantes de este fenómeno se pueden encontrar en la absorción de agua desde el lumen del intestino delgado y en el riñón.
- Inhibidores específicos de la bomba Na/K: Ciertos esteroideos derivados de plantas son potentes inhibidores (K
 10 nM) de la bomba de Na+ y K+. La digitoxigenina y la Ouabína pertenecen a esta clase de inhibidores que se conocen como esteroides cardiotónicos, a causa de sus intensos efectos en el corazón. Estos compuestos inhiben la desfosforilación de la forma E2-P al ser aplicados en la cara externa de la membrana.
10 nM) de la bomba de Na+ y K+. La digitoxigenina y la Ouabína pertenecen a esta clase de inhibidores que se conocen como esteroides cardiotónicos, a causa de sus intensos efectos en el corazón. Estos compuestos inhiben la desfosforilación de la forma E2-P al ser aplicados en la cara externa de la membrana.
La digital, que es una mezcla de esteroides cardiotónicos que se obtiene de las hojas desecadas de la dedalera (Digitalis purpurea). La inhibición de la bomba de Na+ y K+ por la digital conduce a un mayor nivel de Na+ en el interior de la célula disminuyendo así por tanto el gradiente de Na+ a través de la membrana. Como consecuencia, disminuye también la salida de Ca2+ producida por el transportador que intercambia Na+ exterior por Ca2+ interior. El consiguiente aumento en la concentración intracelular de Ca2+ eleva la contractibilidad del musculo cardiaco. Este inhibidor fue utilizado con éxito para tratar la insuficiencia cardiaca congestivo mucho antes del descubrimiento de la bomba de Na+ y K+.
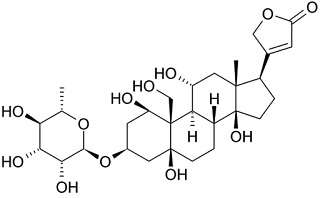 |
| Ouadabain |
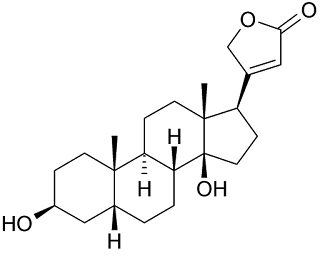 |
| Digitoxigenin |
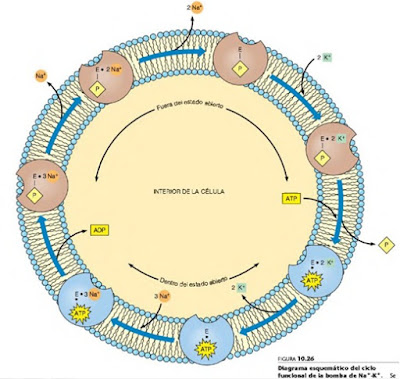
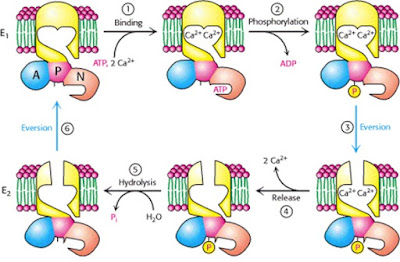
- Ciclo funcional de la ATPasa de Na+/K+: A pesar del transporte en contra de gradientes fuertes, la bomba de sodio-potasio no comporta transgresión alguna de los principios de la termodinámica. La única exigencia es que la hidrolisis del ATP y el transporte estén acoplados. Este acoplamiento se produce al parecer en un proceso de múltiples etapas. Los estudios más completos han llevado a un modelo para el mecanismo de la bomba de Na+-K+ (y otras semejantes). Se ha propuesto que la bomba puede existir en dos tipos de conformaciones, uno abierto hacia el citosol y el otro abierto hacia el entorno celular. La transición a la conformación abierta al citosol, que permite la liberación de K+ y la captura de Na+, se desencadena por la unión de ATP y la liberación de fosfato. El transicional estado abierto al exterior, que permite la liberación de Na+ y la captura de K+, se produce tras la fosforilacion de la subunidad α y la liberación de ADP. El ciclo se muestra en la siguiente imagen:
 |
Bioquímica
las bases moleculares de la vida- tercera edición-
T rudy mcke, James R. Mcke-
página 362
|
1. En conformación E1, tres iones de sodio se unen a la bomba desde el lado citoplásmico de la membrana bicapa de fosfolípidos.
2. ATP fosforila la enzima, como se indica por la P unido al lado citoplásmico de la bomba, y el restante ADP se libera.
3. La conformación cambia entonces a E2, y los tres iones de sodio se liberan en el espacio extracelular.
4. Dos iones de potasio se unen a la bomba desde el lado extracelular.
5. La bomba es desfosforilado y devuelve a la conformación E1.
6. unión de ATP se produce y el potasio se libera en el citoplasma
El estado abierto hacia el exterior E-P es particularmente más afín a los esteroides cardiotónicos como la ouabadina y digitoxogenina los cuales bloquean la enzima en esta conformación.
ATPasas Ser de Ca2+ o SERCA:
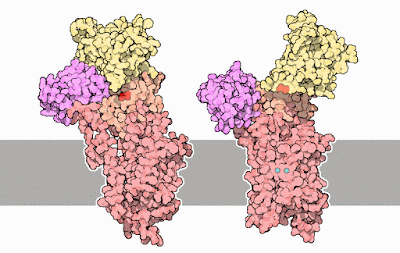
Esta enzima, que constituye el 80% de las proteínas de la membrana del retículo sarcoplásmico, desempeña un papel importante en la concentración muscular, que se dispara por un aumento brusco del nivel de calcio en el citoplasma. La relajación muscular depende de un bombeo rápido de Ca2+ del citoplasma al retículo sarcoplásmico, un compartimiento especializado en el almacenamiento de calcio, mediante el SERCA. Esta bomba mantiene una concentración de Ca2+ de aproximadamente 0.1μM en el citoplasma comparado con el valor de 1.5 mM en el retículo sarcoplásmico.
La SERCA es un polipéptido de 110 Kd con u n dominio de transmembrana que consiste en 10 hélices α. El dominio de transmembrana incluye los centros de unión de los dos iones de calcio. Cada ion de calcio está coordinado con siete átomos de oxigeno que proceden de una combinación de residuos de las cadenas laterales de glutamato, aspartato, treonina, y asparragina, de grupos carbonilo del esqueleto y de moléculas de agua. Cerca de la mitad de la masa molecular de la masa molecular de la proteína está constituida por una gran cabeza citoplasmática que contiene tres dominios distintos. Un dominio (N) une el nucleótido ATP, otra (P) acepta el grupo fosforillo en un residuo conservado de aspartato y el tercero (A) sirve como activador, conectando los cambios en los dominios N y P con la parte transmembrana del enzima.
 |
| Bomba de Calcio |
La estructura SERCA es tremendamente dinámica. Por ejemplo, la estructura de SERCA sin Ca2+ unido es muy distinta a con Ca2+. Los dominios N y P se cierran alrededor del análogo del fosfo-aspartato y el dominio A muestra una rotación notable con respecto a la posición en la que SERCA tenía Ca2+ unido y no existía análogo fosfo-aspartato. Además, la parte transmembrana del enzima ha sufrido una reorganización sustancial y los centros de unión a Ca2+, que mostraba una gran organización, se ha separado. Estos centros son ahora accesibles desde el lado de la membrana opuesto a los dominios N, P y A.
Los resultados estructurales se pueden combinar con otros estudios para construir el mecanismo detallado del bombeo de Ca2+ por SERCA.
- Mecanismo de bombe de Ca2+:
1. La reacción cíclica propuesta se inicia con la enzima en su forma desfosforilada y con dos iones calcio unidos. Nos referimos a la conformación del enzima en este estado como E1; con el Ca2+ unido será E1 (Ca2+)2. En esta conformación, SERCA puede intercambiar iones calcio pero sólo con los iones calcio de la cara citoplasmática de la membrana.
2. En la conformación E1, el enzima puede unirse al ATP. Los dominios N, P y A sufren un fuerte cambio conformacional a medida que se cierran sobre el ATP unido, pero en el dominio transmembrana no se produce un cambio conformacional sustancial. Los iones calcio están ahora atrapados en el interior del enzima.
3. El grupo fosforilo se transfiere ahora del ATP al Asp 351.
4. Tras la liberación del ADP, el enzima experimenta un nuevo cambio conformacional que, esta vez, incluye también al dominio de membrana. Esta nueva conformación se denomina E2 o E2-P en su forma fosforilada. Al proceso de interconversión entre las conformaciones E1 y E2 lo llamamos eversión.
En la conformación E2-P, los centros de unión al Ca2+ se separan de forma que los iones calcio se liberan al lado de la membrana opuesto al que entraron: se han conseguido realizar el transporte de los iones.
5. Se hidroliza el residuo fosfoaspartado y se libera el grupo fosfato.
6. Con la liberación del fosfato, se pierde las interacciones que estabilizaban la conformación E2 y el enzima revierte a la conformación E1.
La unión dos iones calcio del lado citoplásmico cierra el ciclo.
 |
| Ciclo de la bomba de Calcio- Bioquímica las bases moleculares de la vida- tercera edición- T rudy mcke, James R. Mcke- página 362 |
Este mecanismo puede aplicarse básicamente a otras ATPasas tipo P. Por ejemplo, la ATPasa de Na+ - K+ que es un tetrámero α2β2. Su subunidad α es homologa a SERCA e incluye un residuo aspártico calve, análogo al Asp351. La subunidad β no participa directamente en el proceso de transporte iónico. Se puede aplicar un mecanismo de transporte análogo con tres iones de sodio uniéndose en el interior de la célula a la conformación E1 y 2 iones de potasio uniéndose desde el interior a la conformación E2.
►Transportadores ABC:
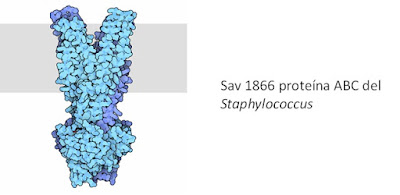
Existe el fenómeno de multirresistencia a fármacos que evidencia el papel de una grande e importante de proteínas que participan en transporte activo, con estructuras y mecanismos muy distintos a los de la familia de las ATPasas tipo P. Este fenómeno es observado en bacterias que construyen bombas especiales que transportan muchos antibióticos diferentes fuera de la célula antes de que puedan hacer su trabajo. Por ejemplo, el Staphylococcus tiene el Sav 1866 que se compone de dos subunidades idénticas de 62 Kd con un túnel en el medio. Medicamentos entran en el túnel, y luego escisión de ATP en la porción grande en la parte inferior provoca un movimiento de tijera, abriendo el túnel en el lado exterior y la liberación de la droga. Esta estructura captura la proteína en este estado final, listo para liberar fármacos hacia arriba, hacia el exterior de la membrana celular.
En E. coli se han encontrado 79 miembros de esta familia y en el genoma humano 150 genes que codifican transportadores ABC que son similares a los de las bacterias, dentro de ellos tenemos al llamado P-glicoproteína (170 Kd), que transporta moléculas similares a las drogas fuera de nuestras células. Se encuentra en la superficie de células en el sistema digestivo, donde nos protege de moléculas tóxicas en nuestra dieta, y en la superficie interna de los vasos sanguíneos en el cerebro, donde forma una segunda línea de defensa que protege nuestro cerebro. Es similar a la Staphylococcus transportador, pero se compone de una cadena de proteína largo en lugar de dos subunidades idénticas. Transporta una amplia variedad de fármacos, tales como ciclosporina A, esteroides tales como hidrocortisona, y los inhibidores de la proteasa utilizados para tratar infecciones por el VIH. También transporta muchos medicamentos contra el cáncer, que pueden causar problemas graves para los pacientes con cáncer. Las células cancerosas, como las bacterias, están constantemente cambiando y mutando, y si desarrollan formas de sobre expresan el transportador, pueden llegar a ser resistentes a la quimioterapia.
Debido a la gran similitud de las dos mitades de la P-glicoproteinas se ha propuesto que una duplicación de genes se produjo durante la evolución de la proteína para conectar estas dos mitades similares en una proteína de largo.
Esta extensa familia tiene en común que están compuestos por 4 dominios: dos dominios que atraviesan la membrana y dos dominios de unión a ATP. Los dominios de unión a ATP de estas proteínas son denominados dominios de unión a ATP de tipo cassete, a los transportadores que incluyen estos dominios se les llama transportadores ABC
 |
| Dominios de transportador ABC |
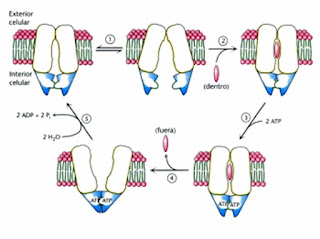
- Mecanismo de transporte:
2. El sustrato entra desde el interior de la célula a la cavidad central de la forma abierta del transportador. La unión al sustrato induce el cambio conformacional en el cassette de unión a ATP aumentando su afinidad por el mismo.
3. El ATP se une a las cassettes de unión a ATP cambiando su conformación de modo que los dos dominios interaccionan fuertemente entre sí.
4. La fuerte interacción entre los cassettes de unión a ATP induce un cambio en la relación entre los dominios que atraviesan la membrana y liberando al sustrato al exterior de la célula.
5. La hidrólisis y la liberación del fosfato inorgánico restaura la proteína para iniciar un nuevo ciclo.
Transporte secundario:
El transporte no necesariamente esta directamente impulsado por la hidrólisis del ATP. En su lugar el flujo de un ion o molécula contra gradiente se acopla al flujo, a favor de gradiente, de una especie química diferente. Las proteínas de membrana que bombean que bombean iones o moléculas contra gradiente por este mecanismo son denominadas transportadores secundarios o cotransportadores.
Los transportadores secundarios son maquinas moleculares muy antiguas, comunes hoy en día tanto entre bacterias, como en arqueas y eucariotas. Por ejemplo 160 proteínas de las cerca de 4000 codificadas por E. coli. Parecen ser transportadores secundarios. La comparación de las secuencias sugieren que los miembros de la familia más extensa tiene 12 hélices transmembrana que parecen haber surgido por duplicación y fusión de una proteína de membrana con 6 hélices transmembrana .
Lactosa permeasa
Dentro de esta familia se incluye
la lactosa permeasa de E. coli. Esta proteína de simporte utiliza el gradiente de H+ a través de la
membrana de E. coli, generado por la oxidación
de combustibles, para impulsar la toma de lactosa y otros azucares en contra de
sus gradientes de concentración. Este transportador es un arquetipo de esta
familia.
La estructura consiste en dos
mitades, cada una de las cuales contiene seis hélices α que atraviesan la membrana. Las dos mitades
se encuentran unidas por una única cadena polipeptídica y generan una cavidad hidrofílica. Una de las mitades contiene mas residuos que interaccionan con el
sustrato y la otra mitad tiene residuos que interactúan con el protón. En esta
estructura, la lactosa se aloja en un bolsillo en el centro de la proteína.
 |
| Estructura de la lactosa permeasa |
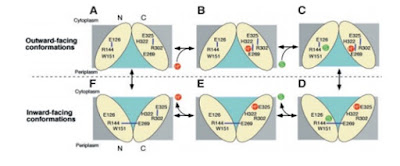
En la figura se muestra los residuos que interaccionan con el sustrato como círculos verdes y los residuos que interaccionan con el protón como círculos amarillos, ademas los sitios de torción están como rectángulos purpura.
En base múltiple experimentos se ha logrado construir un mecanismo de transporte:
1. El ciclo se inicia con las dos mitades orientadas de forma que el bolsillo de unión al azúcar es accesible desde el exterior de la célula. Un protón procedente del exterior de la célula se une al Glu269.
2. En su forma protonada, la permeasa une la lactosa del exterior de la célula.
3. La estructura cambia de conformación .
4. La permeasa libera a la lactosa al interior de la célula .
5. La permeasa libera un protón en el interior de la célula.
6. La permeasa vuelve a cambiar de conformación para completar el ciclo.
El lugar de protonación cambia a largo del ciclo, el cambio de conformación se debe a un enlace puente de hidrógeno generado, a continuación observamos el cambio en el lugar de protonación.
 |
| Mecanismo de transporte de la lactosa permeasa |
Bibliografía
• Bioquímica las bases moleculares de la vida- tercera edición- Trudy mcke, James R. Mcke- página 362
• Biochemestry-5th edition-L. Strayer, J. Timoczko and J. Berg- paginas 528-538
• 414-417 matew
• Bioquimica-sexta edición- L. Strayer, J. Timoczko y J. Berg- paginas 351-361 y 45-63.
• http://www.rcsb.org/pdb/101/motm.do?momID=123 fecha y hora de ingreso:24 de mayo de 2015 a las: 6:00 pm
• http://www.rcsb.org/pdb/101/motm.do?momID=95 fecha y hora de ingreso:24 de mayo de 2015 a las: 6:00
• http://www.rcsb.org/pdb/101/motm.do?momID=51 fecha y hora de ingreso:24 de mayo de 2015 a las: 6:00 pm
• http://www.rcsb.org/pdb/101/motm.do?momID=118 fecha y hora de ingreso:24 de mayo de 2015 a las: 6:00 pm
• http://www.bio.davidson.edu/Courses/Molbio/MolStudents/spring2010/Palmer/TheSodium-PotassiumPump.html fecha y hora de ingreso:24 de mayo de 2015 a las: 6:00 pm
• http://www.cs.stedwards.edu/chem/Chemistry/CHEM43/CHEM43/Projects04/ATPASES/PTYPE_NA_K.HTM fecha y hora de ingreso:24 de mayo de 2015 a las: 6:00 pm
• http://www.rcsb.org/pdb/101/motm.do?momID=39 fecha y hora de ingreso:24 de mayo de 2015 a las: 6:00 pm

No hay comentarios.:
Publicar un comentario