Ciclo celular: interfase y regulación
La vida es un delicado hilo que se quiebra al ser tocado; la manera en la que la vida se mantiene en este planeta es mediante un proceso complicado llamado división celular, esta puede ser de dos tipo: la primera exhibe variabilidad genética y la segunda carece de ella. En esta entrada nos describiremos de qué trata este segundo tipo de división celular llamado mitosis.
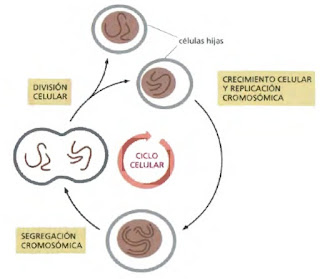 |
| Se muestra la hipotética división de una célula eucariota con dos cromosomas para ilustrar este proceso. |
Según la forma en la que realizan el ciclo celular podemos clasificar a las células en tres tipos:
- Células, como las nerviosas, musculares y demás, que son muy especializadas y carecen de capacidad para dividirse.
- Células que no se dividen en condiciones normales pero que pueden inducirse para inicial la síntesis de DNA y dividirse cuando recibe el estímulo apropiado.
- Células que en condiciones normales tienen un nivel relativamente alto de actividad mitótica.
Contrario a lo que se cree la división celular no es simétrica, en cuanto al material celular, en todos los casos. Existe un tipo de división celular llamado asimétrico en la que dos células hijas tiene propiedades o destinos diferentes. La división asimétrica de una célula madre produce una célula hija que se conserva como un célula madre y otra célula hija que avanzó un paso para convertirse en una célula diferenciada; de este modo se conserva el número de células madres a la vez que se producen células diferenciadas.
El ciclo celular incluye un proceso de separación equitativa del material genético, llamado mitosis, y uno de división física de la célula llamado citocinesis. Entre una división celular y otra existe un periodo llamado interfase donde la célula crece y efectúa diversas actividades metabólicas. La fase M (mitosis) suele durar 1 hora en los mamíferos mientras que la interfase puede extenderse hasta semanas según el tipo celular que sea. La mitosis comprende cinco fases: profase, prometafase, metafase, anafase y telofase. El periodo de interfase se divide en tres subfases: G1 (gap 1), S (synthesis) y G2 (gap 2).
Interfase:
G1: Este es el periodo post mitótico donde ocurre el desarrollo de la célula. Está determinada por la presencia de factores de crecimiento. En esta fase se acumulan materiales para la síntesis que se dará en la siguiente fase. Aquí los cromosomas se encuentran esparcidos en el interior del núcleo formando las fibras nucleosomales, es decir, la condensación del ADN aun no se produce. En células de cultivo se determina que G1 dura 5 hrs. Los organelas se terminan de formar ya que durante la mitosis muchos de ellos se disgregaron. Como veremos posteriormente, al igual que el resto de etapas esta controlado por un grupo de proteínas llamado Cinasas dependientes de ciclina o Cdk (cyclin-dependent kinases).
S: En este periodo se da la síntesis de ADN. El duplex se abre en zonas llamadas horquillas de replicación. Se da la transcripción solamente de los genes necesarios. Este periodo tiene una duración media de 7 hrs.
G2: En este periodo ya todo el ADN ha sido duplicado. Se sigue transcribiendo y traduciendo para el proceso que se avecina. Este periodo tiene una duración media de 3 hrs.
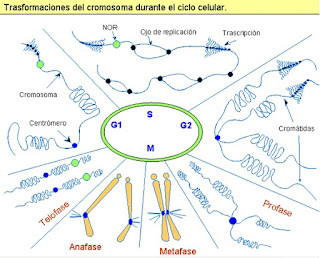 |
| Esta gráfica nos describe el estado de compactación que experimenta un cromosoma durante la mitosis. (NOR: Región organizadora nucleolar en inglés) |
Control del ciclo celular:
Siendo el ciclo celular un proceso tan importante deben de ser estrictamen controlados los procesos que lo componen.
Experimentalmente se demostró que la entrada de una célula a la fase M se inicia por una proteína llamada factor promotor de maduración (MPF, maturation-promoting factor). El MPF tiene dos subunidades, una subunidad con actividad de cinasa que transfiere grupos fosfato del ATP a residuos específicos y otra subunidad reguladora llamada ciclina. El termino ciclina se acuñó porque la concentración de esta proteína reguladora aumenta y disminuye con un patrón predecible en cada ciclo celular. Si la concentración de ciclina se incrementa, la cinasa se activa, lo que hace que la célula ingrese a la fase M.
En los último años se han descubierto enzimas similares a MPF llamadas cinasas dependientes de ciclinas. Estas proteínas fosforilan los residuos de las proteínas implicadas en este proceso.
El paso de G2 a la mitosis requiere la activación de cdc2 (especie de Cdk) por un grupo diferente de ciclinas, las ciclinas mitóticas. Las Cdk que contienen una ciclina mitótica (MPF) fosforilan los sustratos necesarios para que inicie la mitosis, entre estos sustratos están las proteínas indispensables para los cambios dinámicos en la organización de los cromosomas y el citoesqueleto. La salida de la mitosis y el ingreso a G1 depende de un descenso rápido de la actividad de Cdk.
Luego de activarse MPF (ciclina mitótica + Cdk) desarrolla las siguientes funciones:
- Condensación de la cromatina, al fosforilar la histona H1.
- Desorganización de la envoltura nuclear, al fosforilar las láminas.
- Formación del huso mitótico (2 medios husos), al fosforilar los dímeros de tubulina (esto los estabiliza).
- Fragmentación del aparato de golgi y del retículo endoplasmático.
Luego de la acción de MPF la célula posee las siguientes características: turgencia y duplicación del ADN; si la célula no posee alguna de estas características reingresa a G1.
Las ciclinas se unen a la subunidad catalítica de Cdk cuando alcanzan un nivel de concentración suficiente dentro de la célula. La unión con la ciclina produce el movimiento de un asa flexible de la cadena polipeptídica de Cdk para alejarse de la abertura que conduce al sitio activo de la enzima, lo que permite que Cdk fosforile sustratos específicos; estas proteínas al ser fosforiladas cambian su estructura terciaria, este cambio puede bloquear el centro activo de la proteína o desestabilizar la unión que tenía con otra proteína.
 |
| Estructura simplificada de un complejo ciclina-Cdk |
Las células regulan la concentración de ciclinas y otras proteínas clave del ciclo celular mediante el ajuste tanto de la síntesis como de la velocidad de destrucción de la molécula en diferentes partes del ciclo celular. La degradación se logra por la vía de la ubicuitina-proteasoma. La regulación del ciclo celular requiere de complejos que funcionen como ligasas de ubicuitina, estos son APC y SCF. El complejo SCF media la destrucción de las ciclinas G1, los inhibidores de Cdk y otras proteínas del ciclo celular. Las mutaciones que impidan este proceso pueden impedir que se produzca la replicación del DNA. El complejo APC actúa en la mitosis y degrada varias proteínas clave de la mitosis, entre ellas las ciclinas mitóticas; la destrucción de estas últimas permite a la célula salir de la mitosis e inicial un nuevo ciclo celular.
La célula contiene varios compartimentos distintos en los que las moléculas reguladoras pueden unirse o separarse de las proteínas con las que interactúan. La localización subcelular es un fenómeno dinámico en el que los reguladores del ciclo celular se mueven a distintos compartimentos en diferentes etapas. Por ejemplo, una de las principales ciclinas mitóticas de las células animales (ciclina B1) se desplaza entre el núcleo y el citoplasma hasta G2, cuando se acumula en un núcleo justo antes de la mitosis.
Las Cdk no siempre estimulan actividades, también inhiben episodios inapropiados. Por ejemplo, la actividad del complejo ciclina B1-Cdk1 durante G2 impide que la célula replique de nuevo el DNA que ya se replicó en la fase S.
Cdk1 es la única Cdk indispensable para impulsar a la célula de mamífero por todas las etapas del ciclo celular. Es decir, aunque las otras DCk se expresen de manera normal en momentos específicos durante el ciclo celular del mamífero, Cdk1 es capaz de cubrir se ausencia, lo que asegura la fosforilación de todos los sustratos necesarios en cada etapa del ciclo celular. En biología celular se conocen a estos casos como redundancia (dos proteínas realizan una misma función).
Bibliografía:
-Alberts. Biología Molecular de la Célula.quinta edición, 2010, pág 1050-1054.
-Biología Celular y Molecular,- Gerald Karp- 5ta Edición pág 573-579.















