Histología del aparato digestivo de poliquetos
Marco A. Peña F.CC.BB. UNMSM
Resumen: En este trabajo se describirá las características
histológicas principales del sistema digestivo de los poliquetos tomando como
modelos biológicos a Amphitrite johnstoni y
Terebella lapidaria y como referencias principales los trabajos de
Dales 1955 y Sutton 1957
Palabras claves: poliqueto, tubo digestivo, células zimógenas,
tejido excretor y tejido epitelial ciliado.
Aparato digestivo: generalidades
La boca conduce a un largo
esófago estrecho que se abre a una amplia de pared delgada de estómago anterior.
Una región faríngea no puede estrictamente distinguirse. La delantera del
estómago se abre en un estómago posterior, fácilmente reconocible por la gruesa
capa de músculo que le da un aspecto brillante, y pasa a una región intestinal
que conduce hasta el ano. La parte anterior de la intestinal región es en
espiral y la parte posterior es recta y apoyada por septos. (Dales 1955).
Región anterior
Está tapizado por cutícula y
cuando presenta mandíbula son de
proteína cuticular (Hickman 2009). Esta región está constituida por:
Estomodeo
El estomodeo está formado
por un labio superior, labio inferior y
un saco ventral. Teniendo cada uno características histológicas distintas.
La región posterior del labio
superior externamente es constituida por
un tejido epidérmico columnar ciliado revestido
por músculos longitudinales y circulares débilmente desarrollados. Este tejido
epitelial aumenta en altura progresivamente al aproximarse a las regiones
central y proximal del labio y del esófago. Todas las células epiteliales parecen ser
capaces de secreción de mucosa. Inmediatamente
se encuentra el tejido conectivo que
aumenta en profundidad con respecto
aumenta la altura del tejido epitelial columnar. Están asociados músculos dorso-laterales,
un gran plexo nervioso y vasos sanguíneos esenciales para la producción de moco.
La región anterior del labio
superior, superficialmente está compuesta por tejido epitelial
monoestratificado e internamente por tejido conectivo.
El labio inferior está separado de la
peristomio por una ranura profunda y del
saco ventral por una indentación muy superficial.
La región exterior del labio está cubierta por
un epitelio de la altura variada. La región que forma la pared anterior de la
ranura que delimita el labio del peristomio siempre contiene muchas células
secretoras de moco columnares.
La región interna de labio está
revestida por tejido glandular. En esta región se encuentran asociada células mioepitelial
que ayudan a la expulsión de las secreciones.
Posterior al labio inferior se
encuentra el saco ventral cuya pared
anterior tiene células idénticas a las de la región de labio interior. El cojín
ventral incluye células similares pero intercaladas entre ellas, en muchos
especímenes, con células secretoras de moco, acompañadas por tejido glandular.
La pared posterior esta revestida por tejido epitelial cubico, es delgada y
débilmente asociada a secreción de moco.
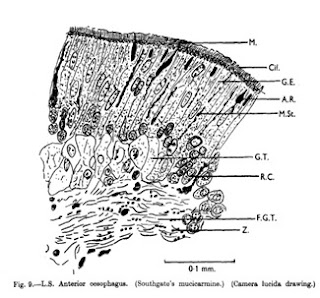
El esófago tiene
externamente un epitelio cubico ciliado, luego tejido glandular bien
desarrollado e internamente tejido conectivo.
Aparentemente, una variación considerable en el grado de desarrollo de
un espécimen a otro. Las diferencias pueden ser correlacionadas con la
variación en la longitud del esófago. De las dos capas musculares longitudinal
es la relativamente mejor desarrollado que el circular.
 |
Región media
La parte anterior de esta región
secreta las enzimas necesarias para la digestión mientras la parte posterior se
encarga de la absorción (Hickman 2009). Está formado por:
Estomago
El estómago que se subdivide en
regiones glandulares y musculares
a) Estomago glandular:
no tiene forma fija, sino que más o menos se puede dividir en regiones anterior
y posterior. Cada una se dilata y se contrae
alternativamente. En la dilatación de la pared está llena de un epitelio
estrecho cubico, con sólo unos pocos bajo pliegues, pero en la contracción que
se echa en los pliegues más profundos con un epitelio más alto columnar. Hay un
ritmo irregular de alternar la contracción y dilatación de las regiones
anterior y posterior.
Externamente a las
células hay una capa de moco, sin duda, derivado del esófago, ya que el propio
estómago no produce moco.
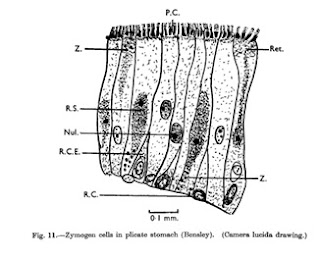
En general las células que revisten el estómago se le llaman
células zimógenas estas pueden ser células glandulares o de absorción,
posiblemente las mismas células pueden cumplir ambas funciones. Las células glandular se encargan de producir
las enzimas proteolíticas necesarias en la digestión estas son columnares ; mientras el otro tipo son
las células de absorción que son cubicas y se encargan de la absorción de las
proteínas digeridas.
- · DALES, R. P. (1955). Feeding and digestion in terebellid polychaetes. J. Mar. biol. Ass. U.R. 34. 65.
- · Hickman C.P. Roberts L.S. Larson A. l’Anson H. & Eisenhour D.J. 2006. Principios Integrales De Zoología. 14ª Ed. McGraw-Hill Interamericana. Madrid. 364-366 pp
- · SUTTON, M. F. (1957, December). The feeding mechanism, functional morphology and histology of the alimentary canal of Terebella lapidaria L.(Polychaeta). In Proceedings of the Zoological Society of London (Vol. 129, No. 4, pp. 487-523). Blackwell Publishing Ltd.
- · VIEITEZ, J.M., At s, C., PARAPAR, J., BESTEIRO, C., MOREIRA, J., NONEZ, J., IABORDA, J. y SAN MARTIN, 0., 2004. Annelida, Polychaeta I. En: Fauna lberka, vol. 25. ItAmos, M.A. et al. (Eds.). Museo Nacional de Ciencias Naturales. CSIC. Madrid. 13, 21, 34 y 37 pp.